Хм, так как же правильно решать задания ЦТ, используя только таблицу Менделеева? Преподаватель химии образовательного центра Адукар Ян Менделеев разобрал этот вопрос. Речь о периодическом законе Менделеева, задания на который встречаются с первого по четвёртое, но по невнимательности абитуриенты часто допускают в них ошибки. Делимся объяснением темы, чтобы как можно больше тех, кто сдают на ЦТ химию, разобрались в этом вопросе.
Рассмотрим таблицу Менделеева. Она устроена таким образом, что все атомы элементов располагаются в зависимости от их заряда ядра. Обратимся к ядерной или планетарной модели Резерфорда о строении атома. Атомы — кирпичики, из которых состоят химические вещества. Атомы у нас состоят из положительно заряженного ядра, и вокруг по орбиталям вращаются отрицательно заряженные электроны. Такая вот планетарная модель. Всё, как у нас в Солнечной системе. Получается, что есть положительно заряженное ядро и вокруг него вращаются отрицательно заряженные электроны.
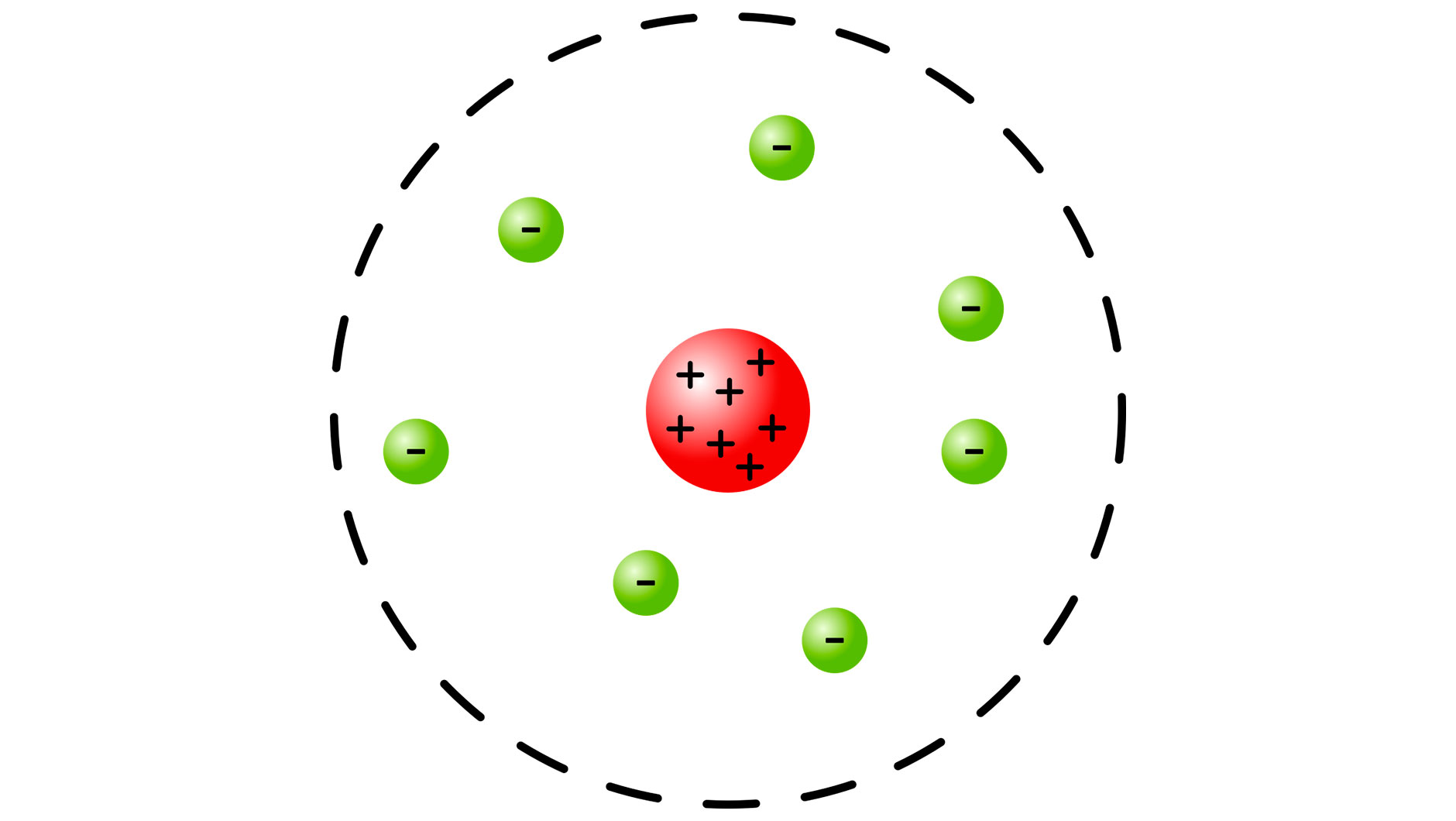
Теперь чуть подробнее о ядре. Оно состоит из двух основных составных частей — это протоны и нейтроны. При этом протоны имеют положительный заряд, а нейтроны имеют отрицательный или нулевой заряд. Кроме ядра ещё есть оболочка, которая состоит из электронов. Электроны — это отрицательно заряженные частицы. И наш атом, который состоит из ядра и оболочки, должен иметь нейтральный заряд, то есть он должен быть по нулевому заряжен. Теперь посмотрим, в какой ситуации у нас может быть такое, что атом будет нейтрально заряжен?
Всё просто: мы должны сделать так, чтобы число протонов и электронов было равно. То есть если у вас число протонов и электронов равно, тогда суммарный заряд равен нулю. Как нам это узнать? Мы берём таблицу Менделеева и смотрим, к примеру, на азот. Атомный номер у товарища азота 7. В периодической системе элементы расположены по возрастанию заряда ядра, и порядковый номер азота и есть заряд его ядра. Теперь вспоминаем, что у нас положительного в ядре? Это протоны. Каждый протон имеет заряд плюс. Из этого следует, что в атоме азота содержится 7 протонов. Атом должен иметь суммарный заряд 0, и мы можем этого достичь только тогда, когда у нас будет 7 протонов и 7 электронов.
Теперь нам нужно разобраться с оставшимися частицами — это нейтрончики. Откуда берутся нейтроны и как узнать их число? Основная масса положительно заряженного атома сосредоточена в ядре. И всё дело в том, что масса электрона существенно меньше массы протона или массы нейтрона. По факту, ей пренебрегают. Поэтому мы считаем, что масса атома в основном сосредоточена в ядре и вклад в массу атома вносят в первую очередь протоны и нейтроны. По таблице Менделеева мы видим, что атом азота весит 14 атомных единиц массы. У нас есть 7 протонов, каждый протон даёт 7 по массе. И, соответственно, чтобы найти число нейтронов, мы от массы отнимаем порядковый номер, 14 — 7, получается 7 нейтронов. Выходит, что атом азота имеет 7 протонов, 7 электронов и 7 нейтронов. Это мы узнали с вами из таблицы Менделеева.

Сейчас мы поговорили про нейтральные атомы. Теперь можем сделать, допустим, из хлора хлор минус. У хлора 17 протонов и 17 электронов. Суммарно это всё даёт электронейтральный атом с зарядом 0. Хлор минус у нас имеет минус, а отрицательно заряженные в нём только электроны. Если у него -1 заряд, значит, у него в атоме будет на один электрон больше. Если мы возьмём 17 протонов и 18 электронов, заряд будет +17 от протонов и -18 от электронов, что в сумме дает -1, что, в принципе, и получилось.

А если мы сделаем, допустим, хлор с плюсом, то здесь, наоборот, будет в атоме 17 протонов, но при этом 16 электронов. Протоны дают +17, -16 дают электроны, суммарно +1. То есть чтобы получить отрицательно заряженную частицу, мы накидываем электроны, чтобы получить положительно заряженную частицу — забираем. Вот такие есть моменты из тех, что чаще всего встречаются в ЦТ.

Теперь по поводу радиуса атома. Радиус — это размер атома. Если мы рассмотрим таблицу Менделеева, то увидим следующую закономерность. У нас есть ряды и колонны. Ряды — это периоды, обозначены цифрами 1, 2, 3, 4 и так далее. Первые три называются малыми, потому что в них меньше всего химических элементов. В первом вообще 2, во втором периоде 8 и в третьем 8, дальше — больше. Колонки — это группы. Есть главные (А) и побочные (В). Смотрим, как изменяется радиус в периоде. Он будет увеличиваться, если мы с вами будем двигаться в направлении справа налево. И наоборот, радиус будет уменьшаться, если мы будем двигаться в обратном направлении. Когда вы двигаетесь по периоду слева направо, заряд ядра растёт, но при этом вспомните, что масса электрона ничтожно мала по сравнению с массой протона. И получается, что заряд ядра растёт, число протонов растёт, а электроны весят мало, даже если их число увеличивается. Выходит, что за счёт увеличения заряда ядра электроны всё сильнее притягиваются к ядру. Условно, у нас есть литий и кислород. У лития заряд +3, а у кислорода заряд +8. Получается, что кислород свои электроны притягивает гораздо сильнее к своему ядру, чем тот же литий. И радиус лития будет больше, чем радиус кислорода.
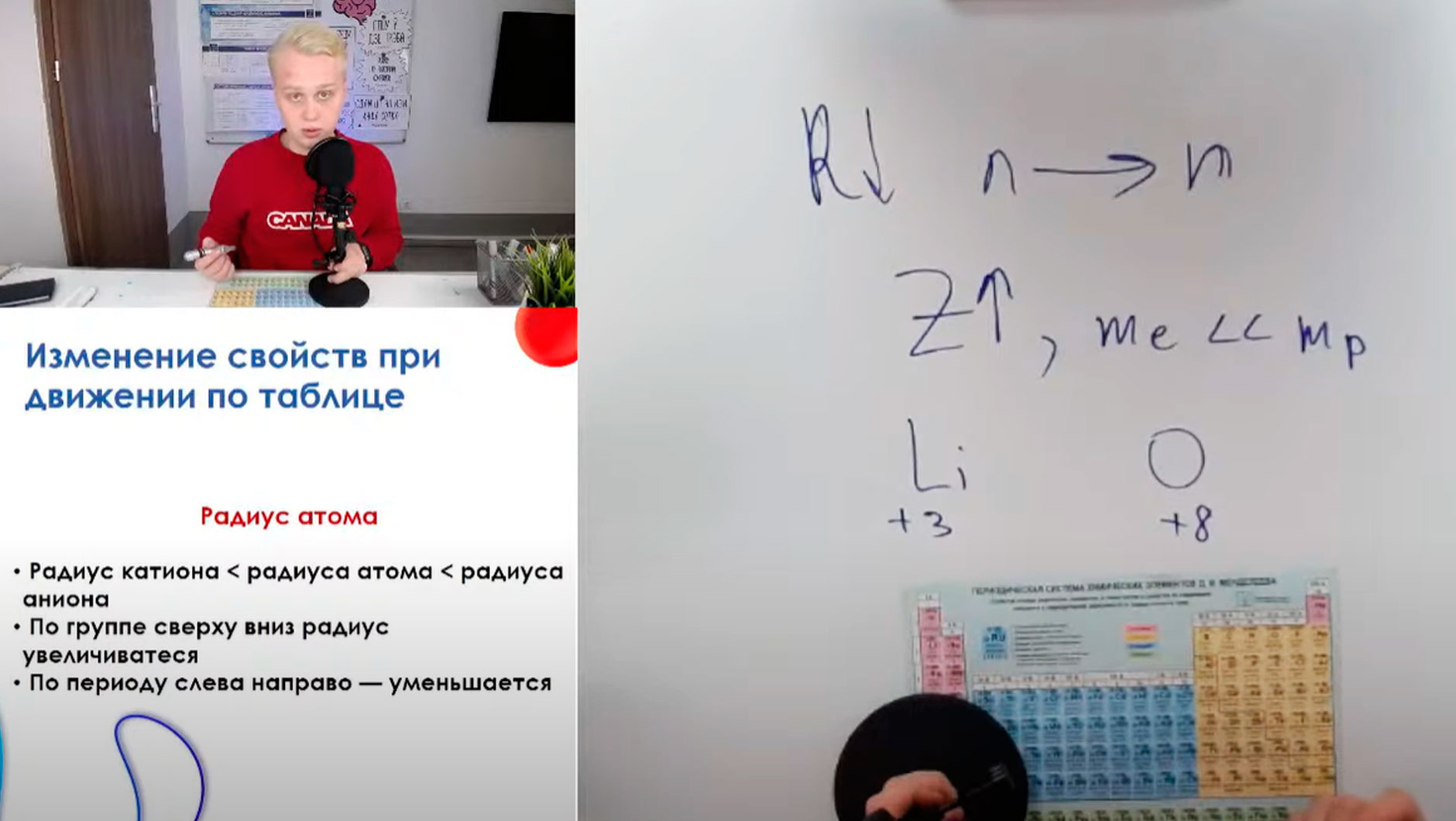
Что по поводу группы. Если мы пойдём по таблице Менделеева сверху вниз, то увидим, что радиус будет расти. Объясняю, почему. Когда вы передвигаетесь по группе сверху вниз, от водорода, например, к францию, у вас будет наращиваться количество электронных слоёв. Электронов становится больше, как слоёв у капусты. И получается, что радиус всё больше и больше.
Теперь по поводу радиуса катиона, иона, аниона и положительно заряженного катиона. Радиус катиона меньше радиуса атома и меньше радиуса аниона. Допустим, у вас есть кислород с положительным зарядом, кислород с нейтральным зарядом и кислород с отрицательным зарядом. Если возьмём кислород с положительным зарядом, то у него в ядре 8 протонов и должно быть 8 электронов, но он положительный, значит, 7 электронов. В нейтральном 8 протонов и 8 электронов, и в отрицательном 8 протонов и 9 электронов. У положительного кислорода заряд ядра +8, а электронов 7, они сильнее притягиваются, соответственно, радиус положительно заряженного будет меньше радиуса нейтрально заряженного атома. То есть вот эти 7 несчастных оставшихся электронов всё сильнее притягиваются, мы забрали электроны с оболочки и ядро сильнее их начинает перетягивать. И остаётся радиус отрицательно заряженного атома. Здесь у нас идёт увеличение числа электронов и вот эти 8 протонов не справляются и не так сильно уже и притягивают к себе эти внешние электроны из оболочки, поэтому радиус у аниона будет наибольшим. Такая вот закономерность.
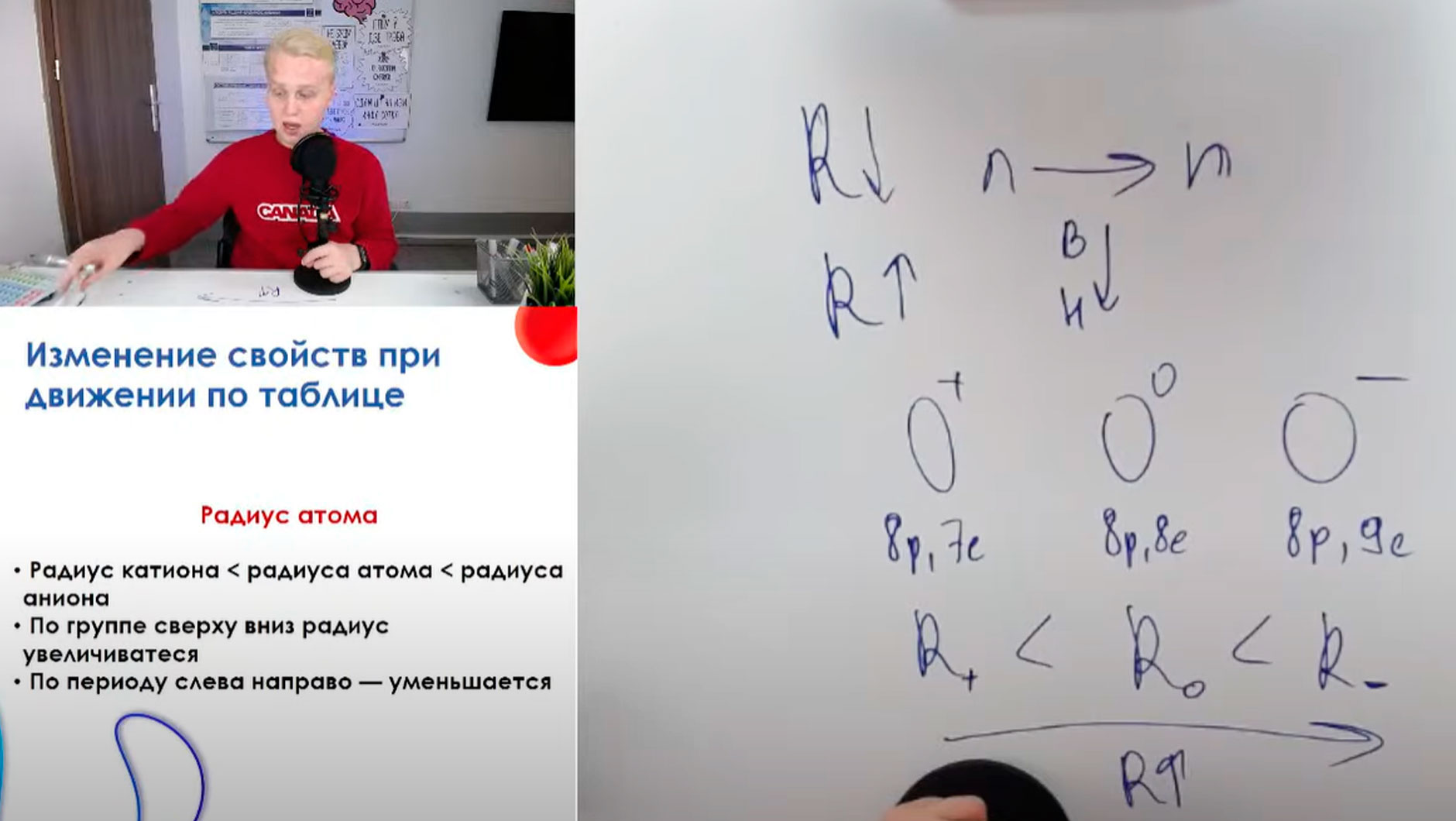
Теперь у нас с вами есть ещё такой момент, как электроотрицательность. Электроотрицательность — это способность атома стягивать на себя чужие электроны. Самый электроотрицательный элемент — это фтор. При движении по таблице мы видим, что чем мы ближе ко фтору, тем выше электроотрицательность. Если мы будем двигаться по группе сверху вниз, электроотрицательность будет падать. Если двигаться по периоду слева направо, электроотрицательность увеличивается".
А теперь предложим вам проверить себя с помощью нескольких тестовых заданий, аналогичных ЦТ по химии. Ответы можно будет найти в конце статьи.
Задание 1. В ряду химических элементов Mg, Al, Si наблюдается:
1) ослабление кислотных свойств их оксидов
2) усиление восстановительной способности
3) уменьшение электроотрицательности
4) уменьшение радиуса атома
Задание 2. Массовое число атома, содержащего 10 нейтронов и 8 электронов, равно…
1) 26
2) 18
3) 16
4) 8
Задание 3. Согласно положению в периодической системе наибольшее значение электроотрицательности имеет химический элемент с порядковым номером…
1) 17
2) 15
3) 6
4) 4
Задание 4. В атоме химического элемента 21 электрон. Его относительная атомная масса равна:
1) 20
2) 21
3) 39
4) 45
Задание 5.
Заряд ядра атома химического элемента +35. Его относительная атомная масса равна:
1) 17
2) 34
3) 80
4) 127
Ответы: 1 — 4, 2 — 2, 3 — 1, 4 — 4, 5 — 3. Подробное объяснение решения каждого из заданий выше есть в записи трансляции (задание 1 — 19:43, задание 2 — 22:46, задание 3 — 26:48, задание 4 — 28:27, задание 5 — 29:17).
Подписывайся на наш YouTube-канал, чтобы смотреть больше видео на тему подготовки к ЦТ и поступления! А ещё лучше приходи на осенний ЦТ-форум, чтобы научится решать и другие задания из ЦТ.
Спасибо, что дочитал до конца. Мы рады, что были полезны. Чтобы получить больше информации, посмотри ещё:
Каталог учебных заведений Адукар
Как сдать ЦТ 2022 на 80 плюс баллов: абитуриенты 2021 делятся советами
Не пропускай важные новости и подписывайся на наш YouTube, ВК, Instagram, Telegram, Facebook, TikTok.
***
Если хотите разместить этот текст на своём сайте или в социальной сети, свяжись с нами по адресу info@adukar.by. Перепечатка материалов возможна только с письменного согласия редакции

